KEYTRUDA® yhdessä solunsalpaajahoidon kanssa on tehokas hoito NSCLC PD-L1 <1% -potilailla

Yhä useamman NSCLC potilaan tarinan on
mahdollisuus jatkua. Myös heidän, joiden
kasvaimen PD-L1 ilmentymä on < 1%.
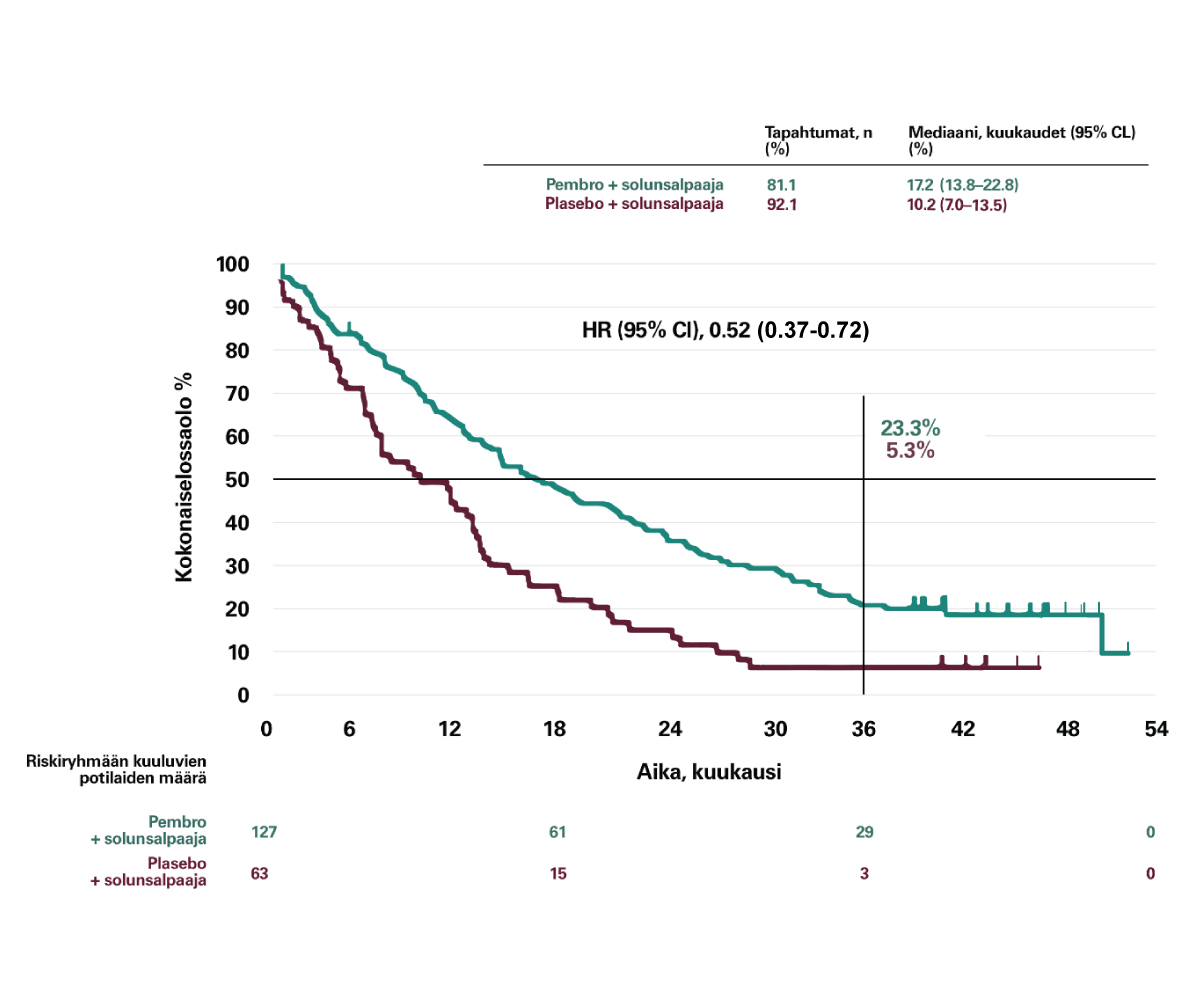
Kokonaiselossaolon mediaani PD-L1 <1% ei-levyepiteelipotilailla:1
KEYNOTE-189
- KEYTRUDA + solunsalpaaja 17,2 kk (13,8-22,8; 95% CI)
- (plasebo+solunsalpaaja 10,2 kk (7,0-13,5; 95% CI))
1. Gray JE, Rodríguez-Abreu D, Powell SF, et al. Pembrolizumab + Pemerexed Platinum for Metastatic NSCLC: 4-Year Follow-Up From KEYNOTE-189. Presented virtuallu at the 2020 World Conference of Lung Cancer (WCLC) January 29-31, 2021
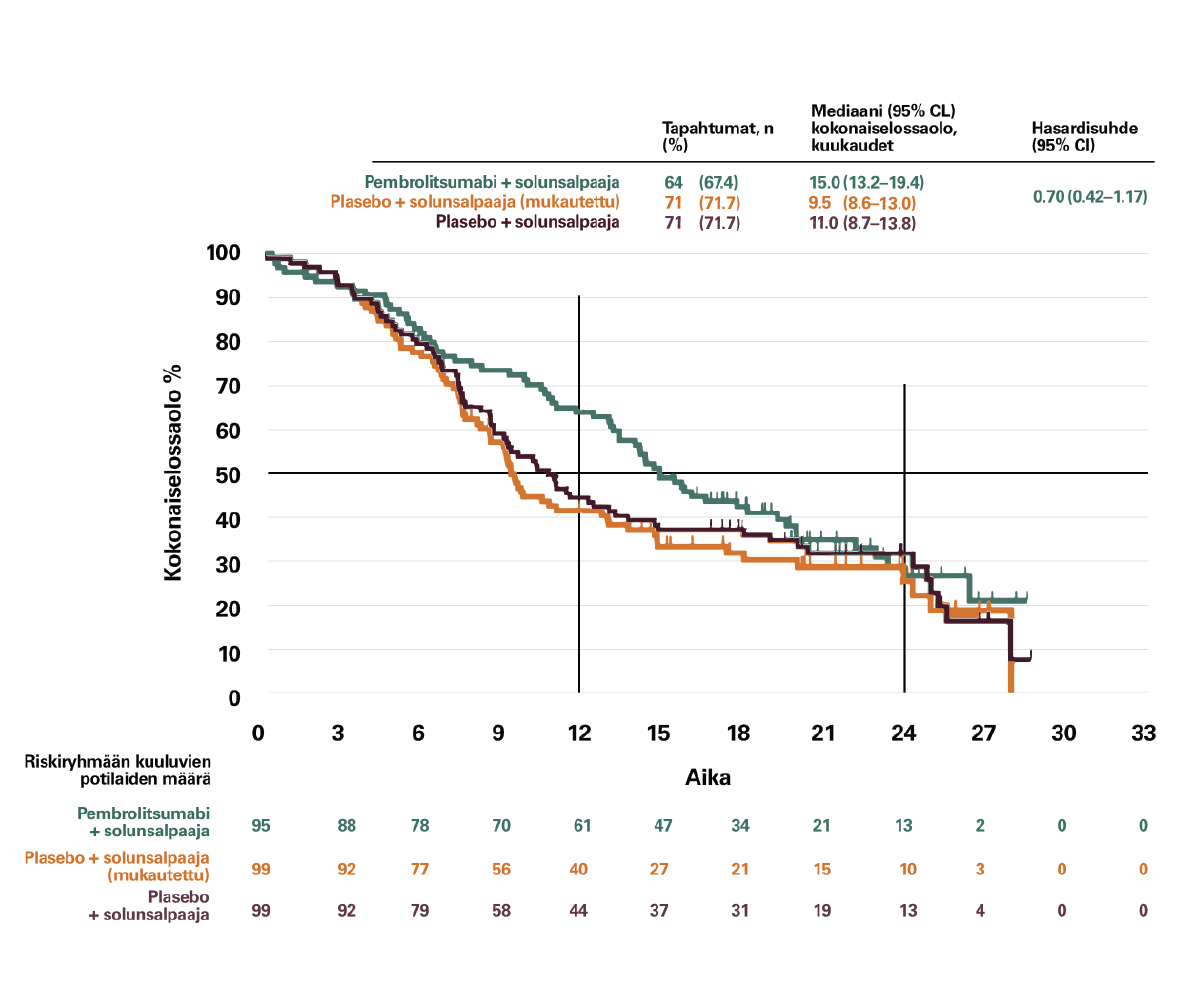
Kokonaiselossalon mediaani PD-L1 <1% levyepiteelipotilailla:2
KEYNOTE-407
- KEYTRUDA + solunsalpaaja 15,0 kk (13,2-19,4; 95% CI)
- (plasebo+solunsalpaaja 11,0 kk (8,7-13,8; 95% CI))
2. Paz-Ares et al. (2020) “A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407”, Journal of Thoracic Oncology, 15(10):1657-1669.
Lisätiedot ei-levyepiteelipopulaation tuloksista3:
- KEYNOTE-189 TUTKIMUSASETELMA
satunnaistettu, kaksoissokkoutettu faasin III tutkimus.
Populaatio: 616 levinnyttä ei-levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavaa potilasta, joilla ei ollut herkistäviä EGFR- tai ALK-mutaatioita ja jotka eivät olleet saaneet aiempaa hoitoa metastasoituneeseen sairauteen. Siirtyminen pembrolitsumabimonoterapiaan sallittiin plasebovalmistetta sisältävää yhdistelmää saaneen ryhmän potilaille, joiden sairaus osoitti etenemistä.
Interventio ja hoidon kesto: Potilaat satunnaistettiin (suhteessa 2:1) saamaan pemetreksediä ja platinapohjaista solunsalpaajaa sekä pembrolitsumabia (n = 410) tai plasebovalmistetta (n = 206) 3 viikon välein 4 hoitojakson ajan ja sen jälkeen ylläpitohoitona pemetreksediä ja pembrolitsumabia tai plasebovalmistetta yhteensä 35 hoitosyklin ajan.
Ensisijainen päätetapahtuma: Ensisijaiset päätetapahtumat olivat kokonaiselossaoloaika ja etenemisvapaa elossaoloaika.
- ITT –POPULAATION TULOKSET
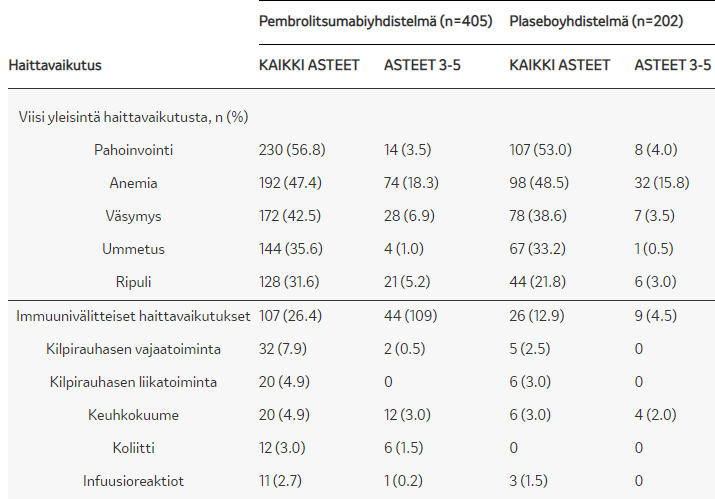
ITT-populaation mediaani kokonaiselossaolo (HR 0,56; 95% CI, 0,45–0,70) Keytruda-yhdistelmähoidolla 22,0 (19,5–25,2) kk vs. plasebo + solunsalpaajalla 10,7 (8,7–13,6) kk. - SIEDETTÄVYYS
3. Gadgeel et al. (2020) ”Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non–Small-Cell Lung Cancer”, Journal of Clinical Oncology, 38(14): 1505-1517.
Lisätiedot levyepiteelipopulaation tuloksista2:
- KEYNOTE-407 TUTKIMUSASETELMA
satunnaistettu, kaksoissokkoutettu faasin III tutkimus.
Satunnaistaminen stratifioitiin seuraavien tekijöiden mukaan: PD-L1:n tumour proportion score [TPS] (≥ 1 % vs. < 1 %; TPS kuvaa PD-L1-värjäytyvien kasvainsolujen osuutta; < 1 % viittaa PD-L1-negatiivisuuteen), käytetty taksaani (paklitakseli vs. nab-paklitakseli) ja osallistujan maantieteellinen alue.
Populaatio: 559 potilasta, joilla oli hoitamaton levinnyt levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä.
Interventio: Potilaat saivat suhteessa 1:1 pembrolitsumabia 200 mg tai plasebovalmisteena käytettyä keittosuolaliuosta enintään 35 hoitosyklin ajan. Lisäksi kaikki potilaat saivat ensimmäisen 4 hoitosyklin ajan karboplatiinia ja joko paklitakselia tai nab-paklitakselia.
Hoidon kesto: Kaikkia hoitoja annettiin laskimoon 3 viikon hoitosykleissä. Hoitoa jatkettiin taudin radiologiseen etenemiseen asti tai kunnes ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä, tutkija päätti lopettaa hoidon tai potilas perui suostumuksensa.
Ensisijainen päätetapahtuma: Ensisijaiset päätetapahtumat olivat kokonaiselossaoloaika ja etenemisvapaa elossaoloaika.
- ITT –POPULAATION TULOKSET
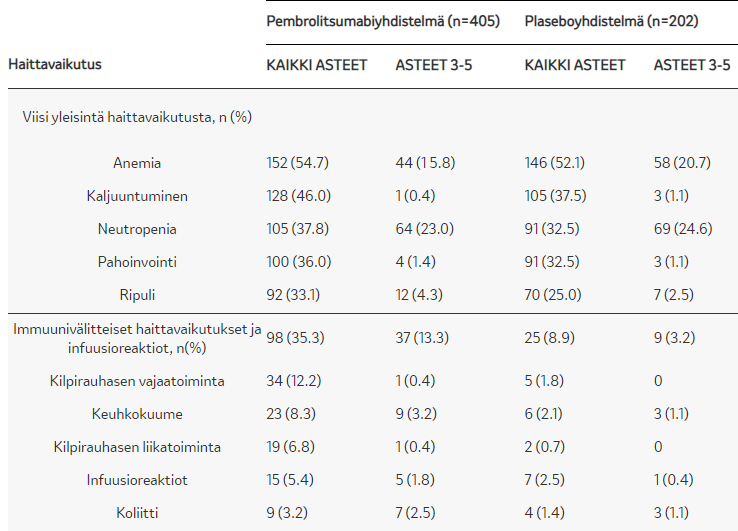
ITT-populaation mediaani (95% CI) kokonaiselossaolo (HR 0,71; 0,58–0,88) Keytruda-yhdistelmähoidolla 17,1 (14,4–19,9) kk vs. plasebo + solunsalpaajahoidolla 11,6 (10,1–13,7) kk. - SIEDETTÄVYYS
2. Paz-Ares et al. (2020) “A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407”, Journal of Thoracic Oncology, 15(10):1657-1669.

MSD Insight
Kohti terveempää tulevaisuutta
Lääkäreille suunnattu MSD Insight sisältää ajantasaista tietosa MSD:n lääkkeistä ja terapia-alueista. Portaalista löydät podcasteja, videoita ja lääketieteellistä tutkimustietoa.
KEYTRUDA valmisteyhteenveto
KEYTRUDA® 25 mg/ml infuusiokonsentraatti, liuosta varten. Vaikuttava aine pembrolitsumabi.
Käyttöaihe: KEYTRUDA monoterapiana on tarkoitettu aikuisille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman hoitoon. KEYTRUDA monoterapiana on tarkoitettu imusolmukkeisiin eden-neen, levinneisyysasteen III melanooman adjuvanttihoitoon aikuisille, joille on tehty täydellinen poistoleikkaus. KEYTRUDA monoterapiana on tarkoitettu metastasoituneen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille, joiden kasvaimet ilmentävät PD-L1-ligandia ja joiden TPS on ≥ 50 % ja joiden kasvaimessa ei ole EGFR- tai ALK-positiivisia mutaatioita. KEYTRUDA yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa on tarkoitettu metastasoituneen, ei-levyepiteeliperäisen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille, joiden kasvaimissa ei ole EGFR- tai ALK-positiivisia mutaatioita. KEYTRUDA yhdistelmänä karboplatiinin ja joko paklitakselin tai nab-paklitakselin kanssa on tarkoitettu metastasoituneen, levyepiteeliperäisen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille. KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen ei-pienisoluisen keuhkosyövän hoitoon aikuisille, joiden kasvaimet ilmentävät PD-L1-ligandia ja joiden TPS on ≥ 1 % ja jotka ovat saaneet aiemmin ainakin yhtä solunsalpaajahoitoa. KEYTRUDA-hoidon aloittamisen edellytyksenä on myös, että potilaat, joiden kasvaimessa on EGFR- tai ALK-positiivisia mutaatioita, ovat aiemmin saaneet täsmähoitoa. KEYTRUDA monoterapiana on tarkoitettu sellaisten aikuisten ja vähintään 3-vuotiaiden pediatristen potilaiden hoitoon, joilla on relapsoitunut ja refraktorinen klassinen Hodgkinin lymfooma ja joilla analoginen kantasolujen siirto on epäonnistunut tai jotka ovat saaneet vähintään kahta aiempaa hoitoa ja joille autologista kantasolujen siirtoa ei voida tehdä. KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoitoon aikui¬sille, jotka ovat aiemmin saaneet platinapohjaista solunsalpaajahoitoa. KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoitoon aikuisille, jotka eivät sovellu saamaan sisplatiinia sisältävää solunsalpaajahoitoa ja joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10. KEYTRUDA monoterapiana tai yhdistelmänä platinaa ja 5-fluorourasiilia (5-FU) sisältävän solunsalpaajahoidon kanssa on tarkoitettu pään ja kaulan alueen metastasoituneen tai leikkaukseen soveltumattoman uusiutuneen levyepiteelikarsinooman ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1. KEYTRUDA monoterapiana on tarkoitettu pään ja kaulan alueen uusiutuneen tai metastasoituneen levyepiteelikarsinooman hoitoon aikuisille, joilla kasvaimet ilmentävät PD-L1-li¬gandia ja joiden TPS on ≥ 50 % ja joilla tauti on edennyt platinapohjaisen solunsalpaajahoidon aikana tai sen jälkeen. KEYTRUDA yhdistelmänä aksitinibin kanssa on tarkoitettu pitkälle edenneen munuaissolukarsinooman ensilinjan hoitoon aikuisille. KEYTRUDA yhdistelmänä lenvatinibin kanssa on tarkoitettu edenneen munuaissolukarsinooman ensilinjan hoitoon aikuisille. KEYTRUDA monoterapiana on tarkoitettu munuaissolukarsinooman adjuvanttihoitoon aikuisille nefrektomian jälkeen, kun uusiutumisriski on suurentunut, tai nefrektomian ja metastaattisten leesioiden poistoleikkauksen jälkeen. KEYTRUDA monoterapiana on tarkoitettu aikuisille sellaisen metastoituneen kolorektaalisyövän ensilinjan hoitoon, johon liittyy miksosatelliitti-instabiliteetti (MSI-H) tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi (dMMR). KEYTRUDA on tarkoitettu yhdistelmänä platinaa ja fluoropyrimidiinia sisältävän solunsalpaajahoidon kanssa paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen ruokatorvisyövän tai ruokatorvi-mahalaukkurajan eli gastroesofageaalisen junktion HER-2-negatiivisen adenokarsinooman ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10. KEYTRUDA yhdistelmänä solunsalpaajahoidon kanssa on tarkoitettu paikallisesti uusiutuneen ja leikkaukseen soveltumattoman tai metastasoituneen kolmoisnegatiivisen rintasyövän hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10 ja jotka eivät ole aiemmin saaneetsolunsalpaajia metastasoituneen taudin hoitoon. KEYTRUDA yhdistelmänä lenvatinibin kanssa on tarkoitettu edenneen tai uusiutuneen endometriumkarsinooman hoitoon aikuisille, joilla tauti on edennyt aiemmin missä tahansa tilanteessa annetun platinapohjaisen hoidon aikana tai sen jälkeen, ja jotka eivät sovellu saamaan parantavaa leikkaus- tai sädehoitoa.
Annostus ja antotapa: Syövän hoitoon perehtyneen erikoislääkärin on aloitettava hoito ja valvottava sen toteuttamista. Jos kyseisessä käyttöaiheessa näin mainitaan, potilaat valitaan saamaan Keytruda valmistetta sen perusteella, todetaanko heillä validoidulla testillä varmistettu PD-L1-ligandin ilmentyminen. Tarkemmat tiedot ks. valmisteyhteenveto.
Annostus: Suositeltu KEYTRUDA-annos aikuisilla on joko 200 mg kolmen viikon välein tai 400 mg kuuden viikon välein annettuna 30 minuutin infuusiona laskimoon. Suositeltu KEYTRUDA-annos monoterapiana vähintään 3-vuotiailla, klassista Hodgkinin lymfoomaa sairastavilla pediatrisilla potilailla on 2 mg/kg (enintään 200 mg) kolmen viikon välein annettuna 30 minuutin infuusiona laskimoon. Kun KEYTRUDA annetaan osana yhdistelmähoitoa solunsalpaajien kanssa, KEYTRUDA on annettava ensin. Katso myös yhdistelmänä annettavien muiden valmisteiden tuo¬tetiedot. KEYTRUDA-hoitoa jatketaan taudin etenemiseen saakka tai kunnes ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Epätyypillisiä vasteita on havaittu (kasvaimen ohimenevää kasvua alkuvaiheessa tai pieniä uusia leesioita ensimmäisten kuukausien aikana, minkä jälkeen kasvain alkaa pienentyä). Jos potilaan kliininen tila on vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaitaan, suositellaan hoidon jatkamista, kunnes taudin eteneminen on varmistunut. Melanooman ja munuaiskarsinooman adjuvanttihoidossa KEYTRUDA-valmistetta annetaan sairauden uusiutumiseen asti tai kunnes ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä, tai enintään vuoden ajan. KEYTRUDA-hoidon muuttamista koskevat suositukset ks. valmisteyhteenveto taulukko 1.
Vasta-aiheet: Yliherkkyys vaikuttavalle aineelle tai apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet: Kasvaimen PD-L1-statuksen määritykseen on tärkeää valita hyvin validoitu ja luotettava menetelmä. Potilaita on seurattava tarkasti infuusioreaktioiden, immuunijärjestelmään liittyvien haittavaikutuksien sekä umpierityssairauksien ja ihoreaktioiden varalta. Haittavaikutuksen vaikeusasteen mukaan KEYTRUDA-hoidosta pidättäydytään toistaiseksi ja haittavaikutukset hoidetaan asianmukaisesti, ks. valmisteyhteenveto. Tietoja tehosta ja turvallisuudesta ≥ 75-vuotiailla potilailla on vähän. KEYTRUDA-valmisteella hoidetuille potilaille on annettava potilaskortti ja heille on kerrottava KEYTRUDA-hoitoon liittyvistä riskeistä. Ks. valmisteyhteenveto kohta 4.4.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset: Systeemisten kortikosteroidien tai immunosuppressiivisten lääkeaineiden käyttöä on vältettävä ennen pembrolitsu-mabihoidon aloittamista, koska ne saattavat heikentää pembrolitsumabin vaikutusta. Systeemisiä kortikosteroideja tai muita immunosuppressiivisia lääkeaineita voidaan käyttää pembrolitsumabihoidon aloittamisen jälkeen immuunijärjestelmään liittyvien haittavaikutusten hoitoon. Kortikosteroideja voidaan myös käyttää esilääkityksenä, kun pembrolitsumabia käytetään yhdistelmänä solunsalpaajien kanssa, pahoinvoinnin ehkäisyyn ja/tai lievittämään solunsalpaajahoitoon liittyviä haittavaikutuksia.
Raskaus ja imetys: Ei ole olemassa tietoja pembrolitsumabin käytöstä raskaana oleville naisille. Ei tiedetä, erittyykö KEYTRUDA ihmisen rintamaitoon.
Haittavaikutukset: Yleisimmät KEYTRUDA-hoidon yhteydessä ilmenevät haittavaikutukset liittyvät immuunijärjestelmään. Useimmat niistä, vaikeat reaktiot mukaan lukien, häviävät asianmukaisen hoidon aloittamisen tai KEYTRUDA-hoidon lopettamisen jälkeen. KEYTRUDA-monoterapiaan liittyvät yleiset ja hyvin yleiset haittavaikutukset: keuhkokuume, anemia, trombosytopenia, lymfopenia, neutropenia, infuusioon liittyvä reaktio, hyportyreoosi, hypertyreoosi, heikentynyt ruokahalu, hyponatremia, hypokalemia, hypokalsemia, unettomuus, päänsärky, heitehuimaus, perifeerinen neuropatia, letargia, makuhäiriö, kuivasilmäisyys, sydämen rytmihäiriö (mukaan lukien eteisvärinä), hypertensio, hengenahdistus, yskä, pneumoniitti, ripuli, vatsakipu, pahoinvointi, oksentelu, ummetus, paksusuolitulehdus, suun kuivuminen, kutina, ihottuma, vaikeat ihoreaktiot, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, valkopälvi, hiustenlähtö, ekseema, aknetyyppinen ihottuma, lihas- ja luukipu, nivelsärky, raajakipu, myosiitti, niveltulehdus, väsymys, voimattomuus, turvotus, kuume, influenssan kaltainen sairaus, vilunväristykset, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kalsiumarvo, kohonnut veren bilirubiiniarvo. KEYTRUDA-yhdistelmähoitoon yhdessä solunsalpaajahoidon kanssa liittyvät yleiset ja hyvin yleiset haittavaikutukset: keuhkokuume, neutropenia, anemia, trombosytopenia, leukopenia, kuumeinen neutropenia, lymfopenia, infuusioon liittyvä reaktio, hypotyreoosi, hypertyreoosi, hypokalemia, heikentynyt ruokahalu, hyponatremia, hypokalsemia, unettomuus, perifeerinen neuropatia, päänsärky, heitehuimaus, letargia, makuhäiriö, kuivasilmäisyys, sydämen rytmihäiriö (mukaan lukien eteisvärinä), hypertensio, hengenahdistus, yskä, pneumoniitti, pahoinvointi, oksentelu, ripuli, vatsakipu, ummetus, paksusuolitulehdus, suun kuivuminen, gastriitti, maksatulehdus, hiustenlähtö, ihottuma, kutina, vaikeat ihoreaktiot, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, lihas- ja luukipu, nivelsärky, myosiitti, raajakipu, niveltulehdus, akuutti munuaisvaurio, väsymys, voimattomuus, kuume, turvotus, influenssan kaltainen sairaus, vilunväristykset, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren kreatiniiniarvo, kohonnut veren kalsiumarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren bilirubiiniarvo. KEYTRUDA-yhdistelmähoitoon yhdessä aksitinibin tai lenvatinibin kanssa liittyvät yleiset ja hyvin yleiset haittavaikutukset: virtsatieinfektio, keuhkokuume, anemia, neutropenia, trombosytopenia, lymfopenia, leukopenia, infuusioon liittyvä reaktio, hypotyreoosi, lisämunuaisen vajaatoiminta, hypertyreoosi, tyreoidiitti, heikentynyt ruokahalu, hyponatremia, hypokalemia, hypokalsemia, unettomuus, päänsärky, makuhäiriö, heitehuimaus, perifeerinen neuropatia, letargia, kuivasilmäisyys, sydämen rytmihäiriö (mukaan lukien eteisvärinä), hypertensio, hengenahdistus, yskä, pneumoniitti, ripuli, vatsakipu, pahoinvointi, oksentelu, ummetus, paksusuolitulehdus, haimatulehdus, gastriitti, suun kuivuminen, maksatulehdus, vaikeat ihoreaktiot, ihottuma/ihotulehdus, kuiva iho, ihon punotus, aknetyyppinen ihottuma, hiustenlähtö, nivelsärky, lihas- ja luukipu, myosiitti, raajakipu, niveltulehdus, munuaistulehdus, väsymys, voimattomuus, turvotus, kuume, influenssan kaltainen sairaus, vilunväristykset, kohonnut lipaasiarvo, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren kreatiniiniarvo, kohonneet amylaasiarvot, kohonnut veren bilirubiiniarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kalsiumarvo. Katso tarkemmat tiedot valmisteyhteenveto taulukko 2.
Säilytys: Säilytä jääkaapissa (2 ºC – 8 ºC). Käyttökuntoon saatetun tai laimennetun lääkevalmisteen säilytys, ks. valmisteyhteenveto.
Korvattavuus: KEYTRUDA ei ole SV-korvattava.
Pakkaus: KEYTRUDA 25 mg/ml infuusiokonsentraatti, liuosta varten: KEYTRUDA 10 ml:n injektiopullo sisältää 4 ml infuusiokonsentraattia, liuosta varten, joka sisältää 100 mg pembrolitsumabia.
Lisätietoja: Valmisteyhteenveto (tekstin muuttamispäivämäärä 17.2.2022), Pharmaca Fennica tai MSD, Keilaranta 3, 02150 Espoo, puh. (09) 804 650.
Tutustu KEYTRUDA-valmisteyhteenvetoon ennen hoidon aloittamista: www.msd.fi/valmisteyhteenvedot