Munuaissolukarsinooman adjuvanttihoito
KEYTRUDA, monoterapiana on tarkoitettu munuaissolukarsinooman adjuvanttihoitoon aikuisille nefrektomian jälkeen, kun uusiutumisriski on keskisuuri tai suuri, tai nefrektomian ja metastaattisten leesioiden poistoleikkauksen jälkeen.1

VAIKUTUSMEKANISMI2
KEYTRUDA (pembrolitsumabi) ei ole solunsalpaaja eikä sädehoito – se on immunologinen hoito, joka auttaa immuunijärjestelmää taistelemaan syöpää vastaan.
KEYTRUDA sitoutuu PD-1-reseptoriin ja salpaa molempien immunosuppressiivisten ligandien, PD-L1:n ja PD-L2:n, vuorovaikutuksen PD-1-reseptorin kanssa ja auttaa näin palauttamaan T-soluihin liittyvää vastetta ja immuunivastetta.
Aktiivisen T-soluvasteen palauttaminen saattaa vaikuttaa sekä normaaleihin terveisiin soluihin että syöpäsoluihin.
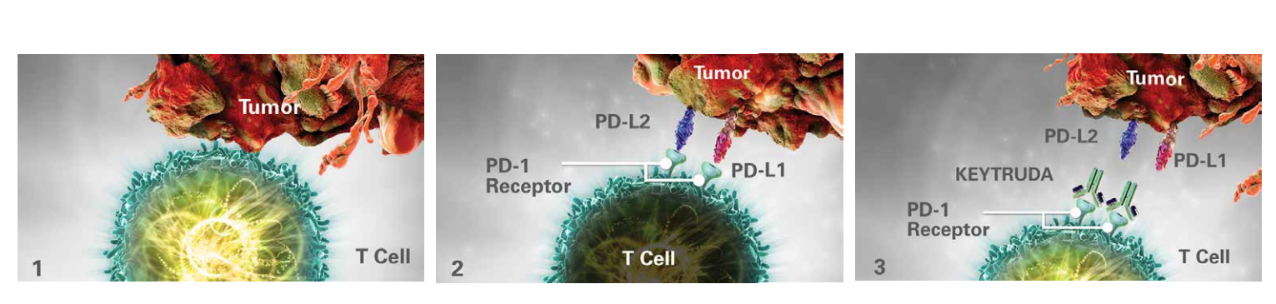
Normaali immuunivaste
Kun T-solujen toiminta on normaalia, ne aktivoituvat ja voivat hyökätä syöpäsolujen tai antigeeneja esittelevien solujen kimppuun.
Kasvaimen evaasio ja T-solujen deaktivaatio
Jotkin kasvaimet piiloutuvat immuunijärjestelmältä PD-L-1-signaalireitin avulla. Kasvaimessa ilmentyvät PD-L-1 ja PD-L-2-ligandit voivat sitoutua T-solujen PD-1-reseptoreihin ja estää T-solujen aktivaation.
T-solujen uudelleenaktivoituminen KEYTRUDA-valmisteen vaikutuksesta
KEYTRUDA sitoutuu PD-1-reseptoriin ja salpaa sen vuorovaikutuksen PD-L-1- ja PD-L-2-ligandien kanssa, mikä osaltaan edistää immuunivasteen palautumista. Tämä vaikuttaa kasvaimeen, mutta voi myös vaikuttaa normaaleihin terveisiin soluihin.
KEYTRUDA on ensimmäinen ja ainoa immunologinen hoito, joka on hyväksytty munuaissolukarsinooman adjuvanttihoitoon nefrektomian jälkeen potilaille, joilla on keskisuuri tai suuri uusiutumisriski.1,6
KEYNOTE-564-tutkimuksen tulokset3
Tutkimuksen ensisijainen päätetapahtuma oli tutkijalääkärin arvioima elinaika ilman tautia (disease-free survival DFS). Toissijainen päätetapahtuma oli kokonaiselinaika (OS).
Sisäänottokriteerit:
- Potilaat, joilla munuaissolukarsinooman uusiutumisen riski oli keskisuuri tai suuri, tai M1 eikä näyttöä taudista (NED) (N=994). Edellytyksenä oli osittainen nefroprotektiivinen tai radikaali täydellinen nefrektomia negatiivisin leikkausmarginaalein ≥ 4 viikkoa ennen seulonta-ajankohtaa.
Poissulkukriteerit:
- Potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus.
Hoito:
- Potilaat satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg 3 viikon välein (n = 496) tai lumelääkettä (n = 498) enintään vuoden ajan, kunnes tauti uusiutui tai ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä.
Elinaika ilman tautia3
Potilaiden seuranta-ajan mediaani oli 24,1 kuukautta (vaihteluväli: 14,9-41,5 kuukautta)
Kaplan—Meier-estimaatit elinajalle ilman tautia KEYNOTE-564-tutkimuksessa
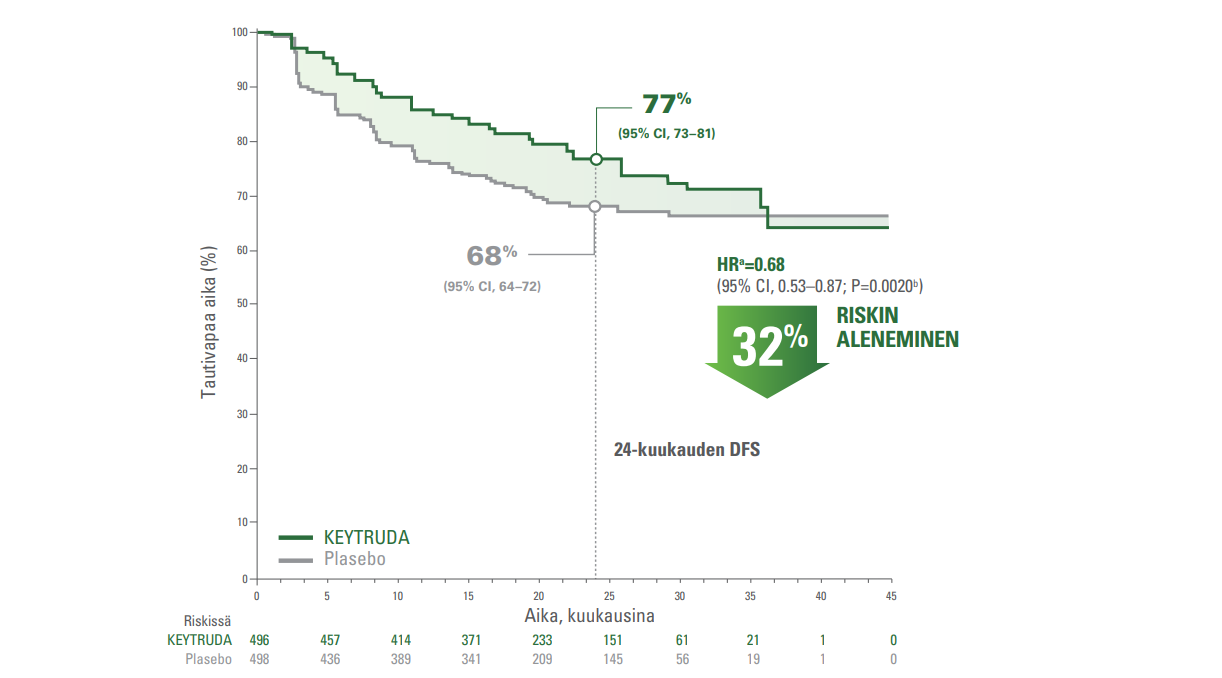
KEYTRUDA vähensi merkitsevästi sairauden uusiutumisen ja kuoleman riskiä lumelääkkeeseen verrattuna.3
Kokonaiselinaika3
Potilaiden seuranta-ajan mediaani oli 57,2 kuukautta (vaihteluväli: 2,5-74,5 kuukautta)
Kaplan—Meier-estimaatit kokonaiselinajalle KEYNOTE-564-tutkimuksessa
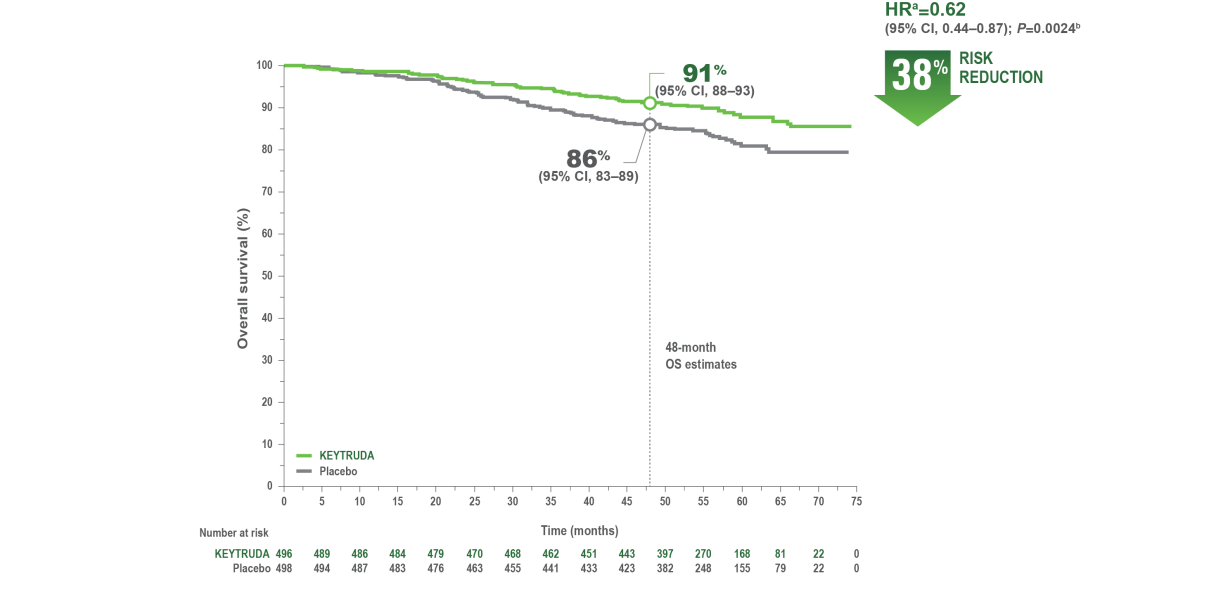
a. Ositetun Coxin verrannollisten riskitiheyksien mallin perusteella.
b. Ositetun log rank -testin perusteella.
Mahdollisia lisäelinpäiviä nefrektomian jälkeen hoitoon soveltuville potilaille, joilla on munuaissolukarsinooma.3
Turvallisuusprofiili: KEYTRUDA vs lumelääke3
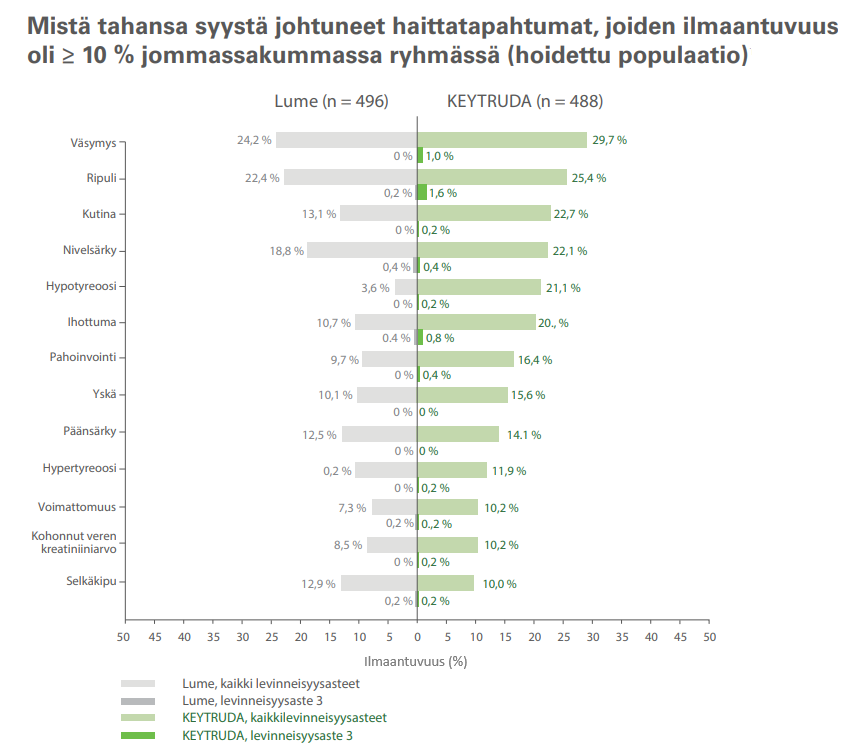
Yhteensä 994 potilasta satunnaistettiin saamaan adjuvanttihoitona joko pembrolitsumabia (496 potilasta) tai lumelääkettä (498 potilasta) (hoitoaikeen mukainen populaatio). Yhteensä 488 potilasta sai KEYTRUDA-valmistetta vähintään 1 annoksen, ja 496 potilasta sai lumelääkettä vähintään 1 annoksen (hoidettu populaatio).
- Potilaita, joilla ei ilmennyt vaikeusasteiden 4 tai 5 haittatapahtumia, oli jommassakummassa ryhmässä vähintään 10 %.
- Turvallisuutta arvioitiin kaikilla potilailla, jotika saivat vähintään 1 annoksen KEYTRUDA-valmistetta tai lumelääkettä.
- KEYTRUDA-altistuksen keston mediaani oli 11,1 kuukautta (vaihteluväli: 0,0–14,3 kuukautta) vs. lume 11,1 kuukautta (vaihteluväli: 0,0–15,4 kuukautta).
- Hoidetussa populaatiossa 96,3 %:lla KEYTRUDA-haaran potilaista ilmeni vähintään 1 minkä tahansa aiheen haittatapahtuma.
- Kaikkiaan 32,4 %:lla KEYTRUDA-valmistetta saaneista potilaista ja 17,7 %:lla lumelääkettä saaneista potilaista ilmeni vaikeusasteiden 3–5 haittatapahtuma.
- Hoitoon liittyviä haittatapahtumia ilmeni 79,1 %:lla KEYTRUDA-haaran potilaista (18,9 %:lla näistä potilaista haitan vaikeusaste oli 3–5) ja 53,4 %:lla lumehaaran potilaista (1,2 %:lla vaikeusaste 3–5).
- Hoidetussa populaatiossa 20,7 % KEYTRUDA-haaran potilaista ja 2,0 % lumehaaran potilaista lopetti hoidon haittatapahtumien vuoksi.
Immuunivälitteiset haittavaikutukset
- KEYTRUDA-valmistetta saaneilla potilailla on ilmennyt immuunivälitteisiä haittavaikutuksia, myös vaikeita ja kuolemaan johtaneita tapauksia. Immuunivälitteisiä haittavaikutuksia voi ilmetä hoidon lopettamisen jälkeen. Kliinisissä tutkimuksissa useimmat immuunivälitteiset haittavaikutukset olivat korjautuvia, ja niitä hoidettiin keskeyttämällä KEYTRUDA-hoito sekä antamalla kortikosteroideja ja/tai tukihoitoa. Useampaan kuin yhteen elinjärjestelmään vaikuttavia immuunivälitteisiä haittavaikutuksia voi ilmetä samanaikaisesti.
- Epäillyt immuunivälitteiset haittavaikutukset on tutkittava asianmukaisesti etiologian varmistamiseksi tai muiden syiden poissulkemiseksi. Haittavaikutuksen vaikeusasteen mukaan pidättäydy KEYTRUDA-hoidosta toistaiseksi ja harkitse kortikosteroidien antamista.. Kun oireet ovat lievittyneet vaikeusasteelle ≤ 1, aloita kortikosteroidin asteittainen vähentäminen ja jatka sitä vähintään 1 kuukauden ajan. Niiden rajallisten tietojen perusteella, joita on saatu kliinisistä tutkimuksista potilailla, joiden immuunivälitteisiä haittavaikutuksia ei saatu hallintaan käyttämällä kortikosteroideja, muiden systeemisten immunosuppressiivisten lääkeaineiden antamista voidaan harkita. Pembrolitsumabihoito voidaan aloittaa uudelleen 12 viikon kuluessa viimeksi annetusta KEYTRUDA-annoksesta, jos haittavaikutus lievittyy vaikeusasteelle, joka on enintään 1 ja kortikosteroidiannos on pienennetty korkeintaan 10 mg:aan prednisonia vuorokaudessa tai vastaavalle tasolle. Pembrolitsumabihoito täytyy lopettaa pysyvästi, jos mikä tahansa vaikeusasteen 3 immuunivälitteinen haittavaikutus ilmaantuu uudelleen tai jos ilmaantuu mikä tahansa vaikeusasteen 4 immuunivälitteinen toksinen haittavaikutus, lukuun ottamatta umpierityssairauksia, joita hoidetaan hormonikorvaushoidoilla.
Joillekin potilaille pelkkä leikkaus ei välttämättä riitä4
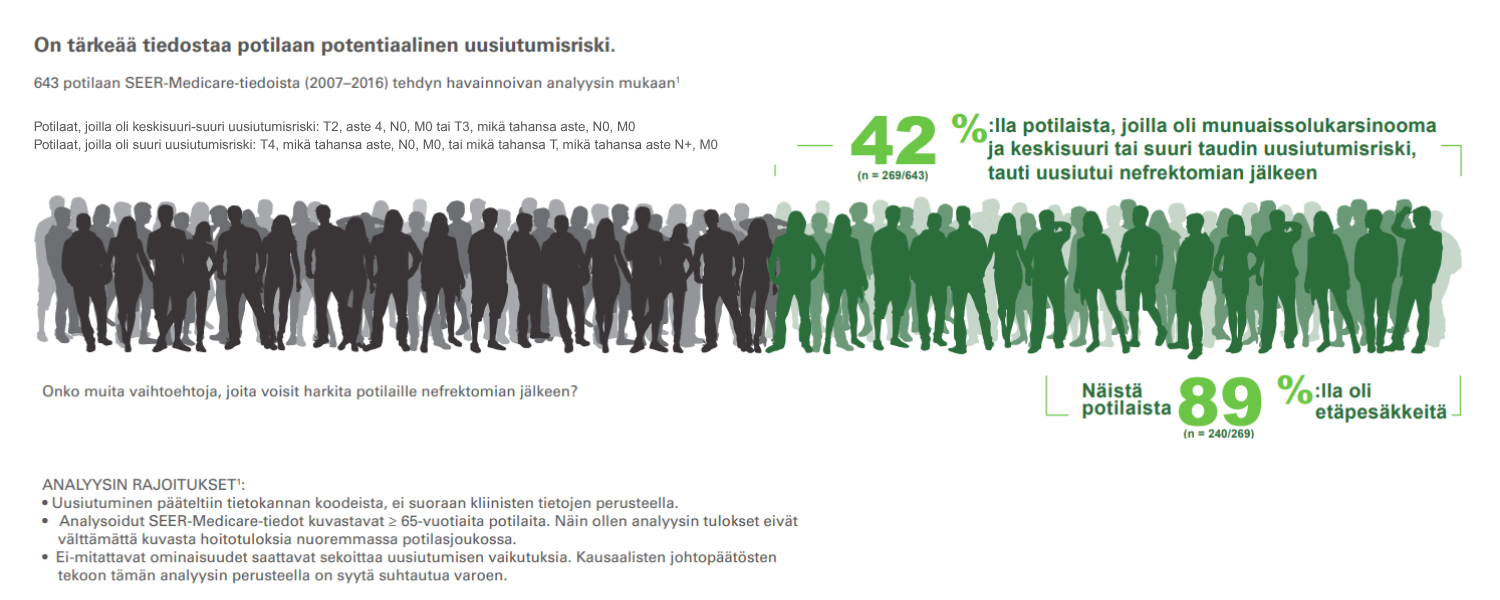
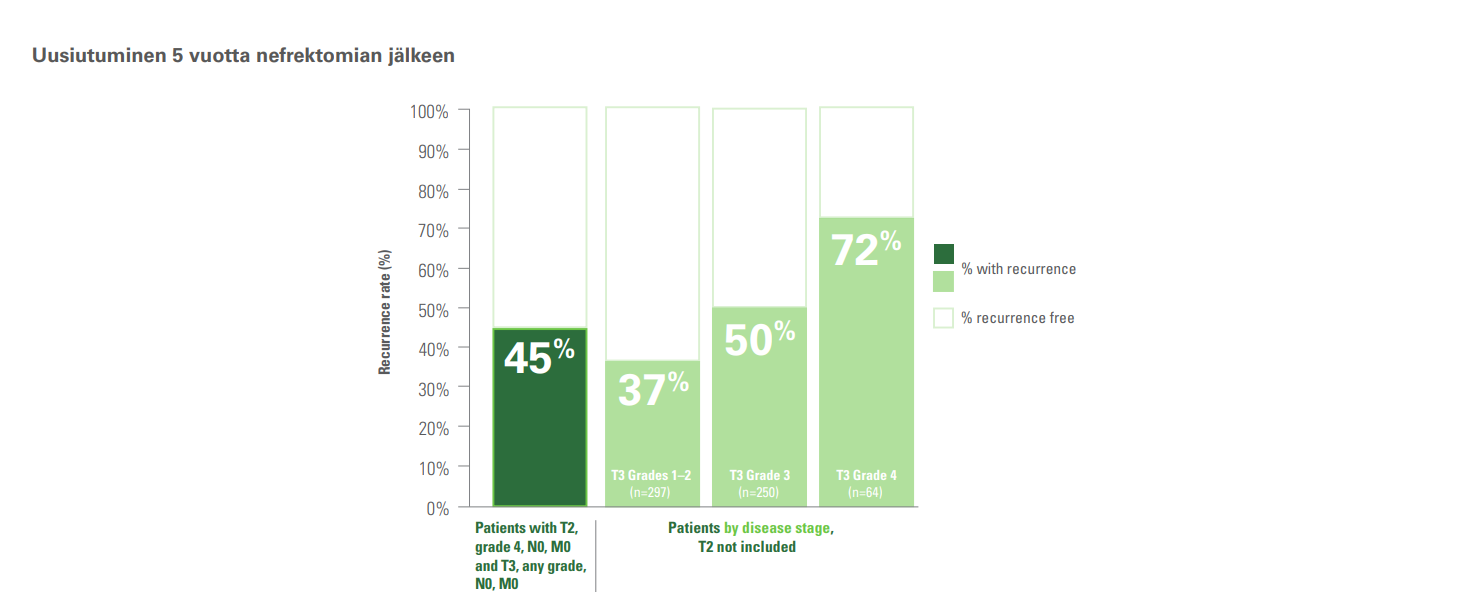
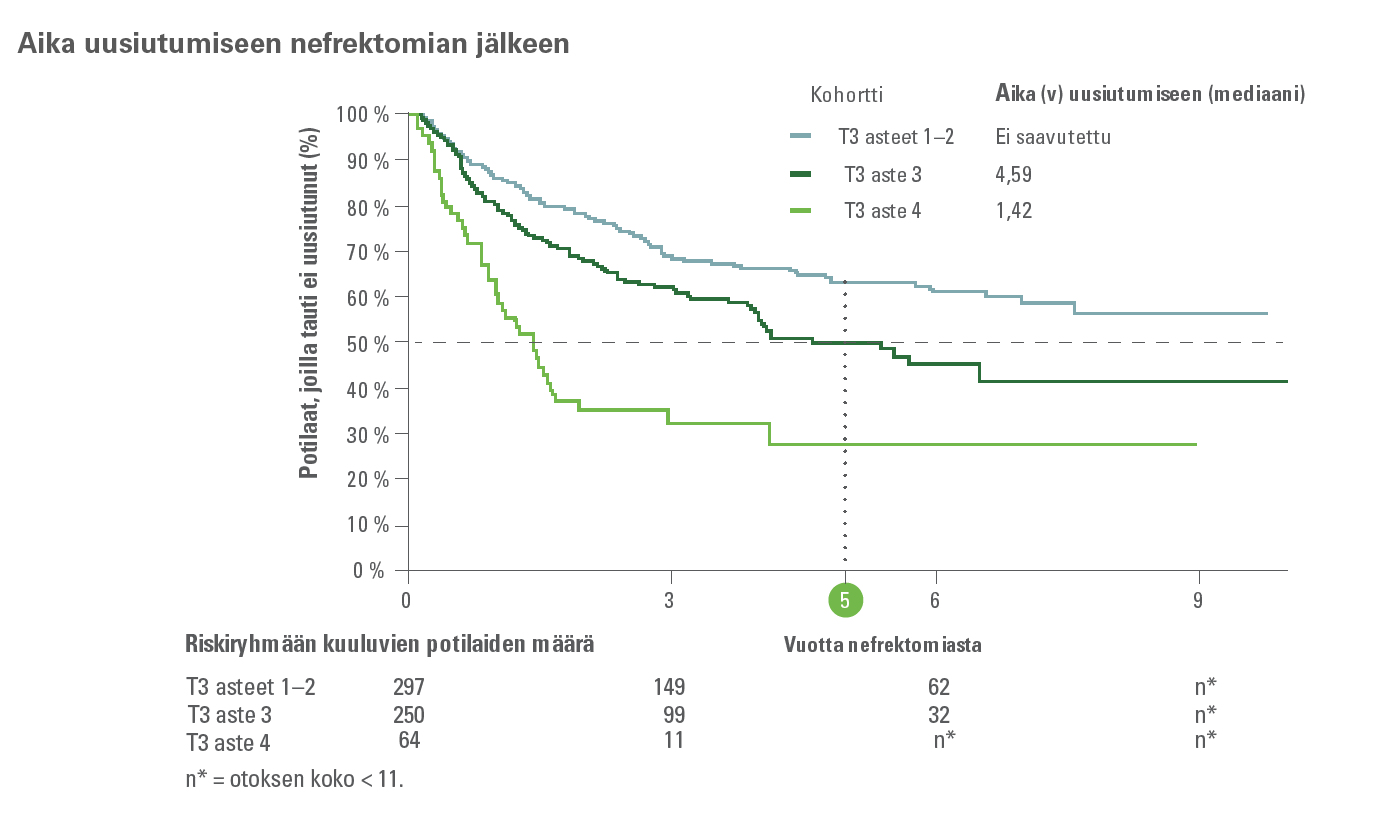
Kaikilla potilailla, joilla oli T3-kasvain, oli uusiutumisriski4,5
SEER-Medicare-tiedoista (2007-2016) tehdyssä alaryhmäanalyysissa oli munuaissolukarsinoomaa sairastavia potilaita, jolle oli tehty nefrektomia. Mukana oli potilaat, joiden kasvainluokitus oli T2, aste 4, N0, M0 tai T3, mikä tahansa aste, N0, M0
KEYNOTE-564: Tutkimusasetelma3
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa KEYNOTE-564 arvioitiin pembrolitsumabin tehoa munuaissolukarsinooman adjuvanttihoitona 994 potilaalla, joilla uusiutumisriski oli suurentunut eli määritelmän mukaan keskisuuri tai suuri tai joilla levinneisyysluokka oli M1 eikä taudista ollut näyttöä (no evidence of disease, NED). Edellytyksenä oli, että potilaille oli tehty osittainen nefroprotektiivinen tai radikaali täydellinen nefrektomia (ja M1-NED-luokkaan kuuluvilla tutkittavilla kiinteiden, yksittäisten, metastaattisten pehmytkudosleesioiden täydellinen poistoleikkaus) negatiivisin leikkausmarginaalein vähintään 4 viikkoa ennen seulonta-ajankohtaa. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus.
Potilaat, joiden munuaissolukarsinoomassa oli kirkassolukomponentti, satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg 3 viikon välein (n = 496) tai lumelääkettä (n = 498) enintään vuoden ajan, kunnes tauti uusiutui tai ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä. Satunnaistamisesta alkaen potilaille tehtiin kuvantamistutkimus 12 viikon välein kahden ensimmäisen vuoden ajan, sitten 16 viikon välein vuosina 3–5 ja sen jälkeen 24 viikon välein joka vuosi. Tehoa mittaava ensisijainen päätetapahtuma oli tutkijalääkärin arvioima elinaika ilman tautia (diseasefree survival, DFS). Keskeinen toissijainen päätetapahtuma oli kokonaiselinaika (OS).
| KEYTRUDA® 25 mg/ml infuusiokonsentraatti, liuosta varten. Vaikuttava aine pembrolitsumabi. Käyttöaihe: Katso tarkemmat valintakriteerit valmisteyhteenvedosta. Melanooma: Monoterapiana aikuisille ja vähintään 12- vuotiaille nuorille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman hoitoon tai täydellisen poistoleikkauksen jälkeen levinneisyysasteen IIB, IIC tai III melanooman adjuvanttihoitoon. Ei- pienisoluinen keuhkosyöpä: Leikkaukseen soveltuvan taudin hoitoon aikuisille, joilla on suuri uusiutumisriski, ensin yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa neoadjuvanttihoitona, sitten adjuvanttihoidossa monoterapiana. Monoterapiana adjuvanttihoitoon aikuisille, kun taudin uusiutumisriski kasvaimen täydellisen poiston ja platinapohjaisen solunsalpaajahoidon jälkeen on suuri. Monoterapiana metastasoituneen taudin ensilinjan hoitoon, kun kasvaimet ilmentävät PD-L1-ligandia ja niiden TPS on ≥ 50 % ja kasvaimessa ei ole EGFR- tai ALK-positiivisia mutaatioita. Yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa aikuisille metastasoituneen, ei-levyepiteeliperäisen taudin ensilinjan hoitoon, kun kasvaimissa ei ole EGFR- tai ALK-positiivisia mutaatioita. Yhdistelmänä karboplatiinin ja joko paklitakselin tai nab-paklitakselin kanssa aikuisille metastasoituneen, levyepiteeliperäisen taudin hoitoon. Monoterapiana paikallisesti edenneen tai metastasoituneen taudin hoitoon aikuisille, joiden kasvaimet ilmentävät PD-L1- ligandia ja joiden TPS on ≥ 1 % ja jotka ovat saaneet aiemmin ainakin yhtä solunsalpaajahoitoa. Potilaiden, joiden kasvaimessa on EGFR- tai ALK-positiivisia mutaatioita, on pitänyt lisäksi aiemmin saada täsmähoitoa. Pahanlaatuinen keuhkopussin mesoteliooma: Yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa leikkaukseen soveltumattoman ei-epitelioidisen pahanlaatuisen keuhkopussin mesoteliooman ensilinjan hoitoon aikuisille. Klassinen Hodgkinin lymfooma: Monoterapiana aikuisille ja vähintään 3-vuotiaille potilaille, joilla on relapsoitunut tai refraktorinen tauti ja joilla autologinen kantasolujen siirto on epäonnistunut tai jotka ovat saaneet vähintään kahta aiempaa hoitoa ja joille autologista kantasolujen siirtoa ei voida tehdä. Uroteelikarsinooma: Yhdistelmänä enfortumabi-vedotiinin kanssa leikkaukseen soveltumattoman tai metastasoituneen taudin ensilinjan hoitoon aikuisille. Monoterapiana paikallisesti edenneen tai metastasoituneen taudin hoitoon aikuisille, jotka ovat aiemmin saaneet platinapohjaista solunsalpaajahoitoa, tai jotka eivät sovellu saamaan sisplatiinia sisältävää solunsalpaajahoitoa ja joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10. Pään ja kaulan alueen levyepiteelikarsinooma: Monoterapiana tai yhdistelmänä platinaa ja 5-fluorourasiilia (5-FU) sisältävän solunsalpaajahoidon kanssa metastasoituneen tai leikkaukseen soveltumattoman uusiutuneen taudin ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1. Monoterapiana uusiutuneen tai metastasoituneen taudin hoitoon aikuisille, joilla kasvaimet ilmentävät PD-L1-ligandia ja joiden TPS on ≥ 50 % ja joilla tauti on edennyt platinapohjaisen solunsalpaajahoidon aikana tai sen jälkeen. Munuaissolukarsinooma: Yhdistelmänä aksitinibin tai lenvatinibin kanssa edenneen taudin ensilinjan hoitoon aikuisille. Monoterapiana adjuvanttihoitoon aikuisille nefrektomian jälkeen, kun uusiutumisriski on suurentunut, tai nefrektomian ja metastaattisten leesioiden poistoleikkauksen jälkeen. Syövät, joihin liittyy MSI-H tai dMMR: Monoterapiana aikuisille: metastoituneen kolorektaalisyövän ensilinjan hoito; leikkaukseen soveltumaton tai metastasoitunut kolorektaalisyöpä, jota on aiemmin hoidettu fluoropyrimidiinipohjaisella yhdistelmähoidolla; edennyt tai uusiutunut endometriumkarsinooma, kun tauti on edennyt aiemmin missä tahansa tilanteessa annetun platinapohjaisen hoidon aikana tai sen jälkeen eikä potilas sovellu saamaan parantavaa leikkaus- tai sädehoitoa; leikkaukseen soveltumaton tai metastasoitunut maha-, ohutsuoli- tai sappitiesyöpä, kun tauti on edennyt vähintään yhden aiemman hoidon aikana tai sen jälkeen. Ruokatorvisyöpä: Yhdistelmänä platinaa ja fluoropyrimidiinia sisältävän solunsalpaajahoidon kanssa paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen taudin ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10. Kolmoisnegatiivinen rintasyöpä: Paikallisesti edenneen tai varhaisvaiheen taudin hoitoon aikuisille, kun uusiutumisriski on suuri, ensin yhdistelmänä solunsalpaajahoidon kanssa neoadjuvanttihoitona, ja leikkauksen jälkeen adjuvanttihoidossa monoterapiana. Yhdistelmänä solunsalpaajahoidon kanssa paikallisesti uusiutuneen ja leikkaukseen soveltumattoman tai metastasoituneen taudin hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10 ja jotka eivät ole aiemmin saaneet solunsalpaajia metastasoituneen taudin hoitoon. Endometriumkarsinooma: Yhdistelmänä karboplatiinin ja paklitakselin kanssa primaaristi edenneen tai uusiutuneen taudin ensilinjan hoitoon aikuisille, jotka soveltuvat saamaan systeemistä hoitoa. Yhdistelmänä lenvatinibin kanssa edenneen tai uusiutuneen taudin hoitoon aikuisille, joilla tauti on edennyt aiemmin missä tahansa tilanteessa annetun platinapohjaisen hoidon aikana tai sen jälkeen, ja jotka eivät sovellu saamaan parantavaa leikkaus- tai sädehoitoa. Kohdunkaulan syöpä: Yhdistelmänä kemosädehoidon (ulkoinen sädehoito ja sen jälkeen brakyterapia) kanssa on tarkoitettu paikallisesti edenneen, FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA taudin hoitoon aikuisille, jotka eivät ole aiemmin saaneet definitiivistä hoitoa. Yhdistelmänä solunsalpaajahoidon (sekä mahdollisen bevasitsumabihoidon) kanssa persistoivan, uusiutuneen tai metastasoituneen taudin hoitoon aikuisille, joilla kasvaimen PD L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1. Mahalaukun tai ruokatorvi- mahalaukkurajan adenokarsinooma: Yhdistelmänä aikuisille trastutsumabin, fluoropyrimidiinin ja platinapohjaisen solunsalpaajahoidon kanssa paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen HER2-positiivisen taudin ensilinjan hoitoon kun kasvaimen PD L1-ligandin ilmentymisen CPS-pistemäärä on ≥1. Yhdistelmänä aikuisille fluoropyrimidiinin ja platinapohjaisen solunsalpaajahoidon kanssa paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen HER2-negatiivisen taudin ensilinjan hoitoon; kasvaimen PD L1-ligandin ilmentymisen CPS-pistemäärän tulee olla ≥ 1. Sappitiesyöpä: Yhdistelmänä gemsitabiinin ja sisplatiinin kanssa paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen taudin ensilinjan hoitoon aikuisille. Annostus ja antotapa: Syövän hoitoon perehtyneen erikoislääkärin on aloitettava hoito ja valvottava sen toteuttamista. Huomioi potilasvalinnassa käyttöaihekohtaiset vaatimukset PD-L1-ligandin ilmentymisen tai MSI-H:n tai dMMR:n toteamisesta. Tarkemmat t iedot ks. valmisteyhteenveto. Annostus: Suositeltu KEYTRUDA-annos aikuisilla on joko 200 mg kolmen viikon välein tai 400 mg kuuden viikon välein annettuna 30 minuutin infuusiona laskimoon. Suositeltu KEYTRUDA- annos monoterapiana vähintään 3-vuotiailla, klassista Hodgkinin lymfoomaa sairastavilla pediatrisilla potilailla tai vähintään 12-vuotiailla, melanoomaa sairastavilla potilailla on 2 mg/kg (enintään 200 mg) kolmen viikon välein annettuna 30 minuutin infuusiona laskimoon. Kun KEYTRUDA annetaan osana yhdistelmähoitoa laskimoon annettavan solunsalpaajahoidon kanssa, KEYTRUDA on annettava ensin. Yhdistelmähoidossa enfortumabi-vedotiinin kanssa KEYTRUDA annetaan enfortumabi-vedotiinin jälkeen, jos ne annetaan samana päivänä. Katso tarkemmat tiedot annosohjelmista ja haittavaikutusten hallinnasta valmisteyhteenvedosta. Vasta-aiheet: Yliherkkyys vaikuttavalle aineelle tai apuaineille. Varoitukset ja käyttöön liittyvät varotoimet: Kasvaimen PD-L1-statuksen määritykseen on tärkeää valita hyvin validoitu ja luotettava menetelmä. Pembrolitsumabia saaneilla potilailla on ilmennyt immuunivälitteisiä haittavaikutuksia, yleensä korjaantuvia mutta myös vaikeita ja kuolemaan johtaneita tapauksia. Hoida keskeyttämällä pembrolitsumabihoito sekä antamalla kortikosteroideja ja/tai tukihoitoa, varmista etiologia ja sulje pois muut syyt. Potilaita on seurattava tarkasti infuusioreaktioiden, immuunijärjestelmään liittyvien haittavaikutuksien sekä umpierityssairauksien ja ihoreaktioiden varalta. Haittavaikutuksen vaikeusasteen mukaan KEYTRUDA-hoidosta pidättäydytään toistaiseksi ja haittavaikutukset hoidetaan asianmukaisesti, ks. valmisteyhteenveto. KEYTRUDA-valmisteella hoidetuille potilaille on annettava potilaskortti ja heille on kerrottava KEYTRUDA-hoitoon liittyvistä riskeistä. Ks. valmisteyhteenveto kohta 4.4. Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset: Systeemisten kortikosteroidien tai immunosuppressiivisten lääkeaineiden käyttöä on vältettävä ennen pembrolitsumabihoidon aloittamista, koska ne saattavat heikentää pembrolitsumabin vaikutusta. Niitä voidaan käyttää pembrolitsumabihoidon aloittamisen jälkeen immuunijärjestelmään liittyvien haittavaikutusten hoitoon, kortikosteroideja myös esilääkityksenä käytettäessä yhdistelmähoitoa solunsalpaajien kanssa. Raskaus ja imetys: Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä pembrolitsumabihoidon aikana ja vähintään 4 kuukauden ajan viimeisen pembrolitsumabiannoksen jälkeen. Ei pidä käyttää raskauden aikana, paitsi jos naisen kliininen tila vaatii pembrolitsumabihoitoa. Imetys: On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko pembrolitsumabihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille. Vaikutus ajokykyyn ja koneidenkäyttökykyyn: Vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Haittavaikutukset: KEYTRUDA-monoterapiaan liittyvät yleiset ja hyvin yleiset haittavaikutukset: keuhkokuume, anemia, trombosytopenia, neutropenia, lymfopenia, infuusioon liittyvä reaktio, hypotyreoosi, hypertyreoosi, heikentynyt ruokahalu, hyponatremia, hypokalemia, hypokalsemia, unettomuus, päänsärky, heitehuimaus, perifeerinen neuropatia, letargia, makuhäiriö, kuivasilmäisyys, sydämen rytmihäiriö (mukaan lukien eteisvärinä), hypertensio, hengenahdistus, yskä, pneumoniitti, ripuli, vatsakipu, pahoinvointi, oksentelu, ummetus, paksusuolitulehdus, suun kuivuminen, maksatulehdus, kutina, ihottuma, vaikeat ihoreaktiot, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, valkopälvi, ekseema, hiustenlähtö, aknetyyppinen ihottuma, lihas- ja luukipu, nivelsärky, myosiitti, raajakipu, niveltulehdus, väsymys, voimattomuus, turvotus, kuume, influenssan kaltainen sairaus, vilunväristykset, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kalsiumarvo, kohonnut veren bilirubiiniarvo, kohonnut veren kreatiniiniarvo. KEYTRUDA- yhdistelmähoitoon yhdessä solunsalpaajahoidon kanssa liittyvät yleiset ja hyvin yleiset haittavaikutukset: keuhkokuume, anemia, neutropenia, trombosytopenia, kuumeinen neutropenia, leukopenia, lymfopenia, infuusioon liittyvä reaktio, hypotyreoosi, lisämunuaisen vajaatoiminta, tyreoidiitti, hypertyreoosi, hypokalemia, heikentynyt ruokahalu, hyponatremia, hypokalsemia, unettomuus, perifeerinen neuropatia, päänsärky, heitehuimaus, makuhäiriö, kuivasilmäisyys, sydämen rytmihäiriö (mukaan lukien eteisvärinä), hypertensio, hengenahdistus, yskä, pneumoniitti, ripuli, oksentelu, pahoinvointi, vatsakipu, ummetus, paksusuolitulehdus, gastriitti, suun kuivuminen, maksatulehdus, hiustenlähtö, kutina, ihottuma, vaikeat ihoreaktiot, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, aknetyyppinen ihottuma, ekseema, lihas- ja luukipu, nivelsärky, myosiitti, raajakipu, niveltulehdus, akuutti munuaisvaurio, väsymys, voimattomuus, kuume, turvotus, influenssan kaltainen sairaus, vilunväristykset, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren bilirubiiniarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kreatiniiniarvo, kohonnut veren kalsiumarvo. Katso harvinaisemmat haittavaikutukset ja yhdistelmähoidossa tyrosiinikinaasin estäjien tai enfortumabi-vedotiinin kanssa havaitut haittavaikutukset valmisteyhteenvedon taulukosta 2 sekä yhdistettävän valmisteen valmisteyhteenvedosta. Säilytys: Säilytä jääkaapissa (2 ºC – 8 ºC). Käyttökuntoon saatetun tai laimennetun lääkevalmisteen säilytys, ks. valmisteyhteenveto. Korvattavuus: KEYTRUDA ei ole SV-korvattava. Pakkaus ja hinta (tmh ilman alv 08/2025): KEYTRUDA 25 mg/ml infuusiokonsentraatti, liuosta varten: KEYTRUDA 10 ml:n injektiopullo sisältää 4 ml infuusiokonsentraattia, liuosta varten, joka sisältää 100 mg pembrolitsumabia (3566 €). Lisätietoja: Valmisteyhteenveto (tekstin muuttamispäivämäärä 20.6.2025), Pharmaca Fennica tai MSD, Keilaniementie 1, 02150 Espoo, puh. (09) 804 650. Tutustu KEYTRUDA-valmisteyhteenvetoon ennen hoidon aloittamista: www.msd.fi/valmisteyhteenvedot FI-KEY-00677 08/2025 |
Lähteet
- KEYTRUDA valmisteyhteenveto
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12(4): 252-264.
- ChoueriTK, Tomczak P, Park SH, et al; for the KEYNOTE-564 investigators. Adjuvant pembrolizumab adter nephrectomy in renal-cell carcinoma. N Engl J Med. 2021;385(8):683-694.
- Sundaram M, Song Y, Rogerio JW, et al. Clinical and economic burdens of recurrence following nephrectomy for intermediate high- or high-risk renal cell carcinoma: a retrospective analysis of Surveillance, Epidemiology, and End Results–Medicare data. J Manag Care Spec Pharm. 2022;28(10):1149–1160. doi:10.18553/jmcp.2022.22133.
- Sundaram M, Song Y, Rogerio JW, et al. Supplementary Appendix to: Clinical and economic burdens of recurrence following nephrectomy for intermediate high- or high-risk renal cell carcinoma: a retrospective analysis of Surveillance, Epidemiology, and End Results–Medicare data. J Manag Care Spec Pharm. 2022;28(10):1149–1160. Viitattu 22.11.2022. https://www.jmcp.org/pb-assets/Supplmental%20Material/SupplementaryMaterials22133-1661527087.pdf
- Euroopan lääkevirasto Assessment report for KEYTRUDA for adjuvant treatment in monotherapy of adults with RCC. [EMA/233031/2022]. Viitattu 24.2.2023